Bài viết Áp lực đẩy là gì? Đo áp lực đẩy thế nào ngay tại giường? – Tải file PDF Tại đây.
Oriol Roca, Ewan Goligher and Marcelo B. p. Amato
Lược dịch: BS. Nguyễn Đình Tuấn – Bệnh Viện Vũng Tàu
Áp lực đẩy (AP) được định nghĩa là áp lực căng phổi cao hơn áp lực dương cuối thì thở ra (PEEP) được cài đặt, được đòi hỏi để tạo ra thể tích khí lưu thông (Vt). Nó được tạo ra bởi các lực đàn hồi phát sinh trong quá trình căng phồng phổi do khí lưu thông. Do đó, áp lực đẩy bị ảnh hưởng bởi mức độ căng phồng phổi do khí lưu thông và độ đàn hồi của phổi và lồng ngực, nó có thể được biểu thị bằng tỷ lệ giữa Vt và độ giãn nở của hệ thống hô hấp (Crs1) (AP = Vt/Crs) [1 ]. Độ đàn hồi (và ngược lại với nó là độ giãn nở) của phổi phản ánh khả năng hoạt động chức năng của phổi. Vì độ đàn hồi đặc trưng của vùng phổi nhỏ không bị ảnh hưởng bởi hội chứng suy hô hấp cấp tính (ARDS) (nghĩa là các vùng phổi không bị ảnh hưởng vẫn duy trì các đặc tính cơ học bình thường của chúng), làm tăng độ đàn hồi chung của phổi gây giảm thể tích phổi: độ đàn hồi tăng theo số lượng đơn vị phổi (acini) sẵn có góp phần giảm thể tích khí lưu thông. Mối quan hệ giữa độ đàn hồi và thể tích phổi đã được chứng minh trong một nghiên cứu chụp cắt lớp vi tính (CT) cổ điển của Gattinoni và cộng sự [2]. Ở những bệnh nhân được đặt nội khí quản, AP có thể được tính toán dễ dàng trong các điều kiện bán tĩnh bằng áp lực bình nguyên (Pplat2) trừ đi tổng PEEP [3]. Tuy nhiên, mặc dù phép đo này hoàn toàn đáng tin cậy ở những bệnh nhân hoàn toàn thụ động, nó có thể có sai số do ảnh hưởng của cơ hô hấp ở bệnh nhân thở máy hỗ trợ.
Tại sao áp lực đẩy có liên quan về mặt lâm sàng?
Tầm quan trọng của AP lần đầu tiên được mô tả trong một phân tích hậu định từ các nghiên cứu ngẫu nhiên khác nhau đánh giá việc sử dụng thông khí Vt thấp hoặc PEEP cao hơn ở bệnh nhân ARDS [1]. Kết quả của phân tích này cho thấy trong quá trình thông khí có kiểm soát, mức AP cao hơn có liên quan độc lập với tỷ lệ tử vong, bất kể mức PEEP, Vt hoặc Pplat. Ngoài ra, AP đã được chứng minh là trung gian cho mối liên quan giữa Vt và tỷ lệ tử vong hoặc giữa PEEP và tỷ lệ tử vong. Tương tự, AP cao hơn cũng có liên quan đến tiến triển ARDS ở những bệnh nhân không có bằng chứng lâm sàng về tổn thương phổi tại thời điểm đặt nội khí quản [4].
Một phân tích thứ cấp gần đây của năm nghiên cứu ngẫu nhiên cho thấy rằng lợi ích đới với tử vong của việc giảm Vt ở bệnh nhân ARDS chỉ được quan sát thấy ở những bệnh nhân có hệ thống hô hấp với độ đàn hồi cao, cho thấy căng phổi (lung stress[1]) hơn là do căng phồng phổi, là một yếu tố quyết định của tổn thương phổi do thở máy (VILI[2]) [5]. Khi AP thấp (< 15cmH2O), không có sự khác biệt về tỷ lệ tử vong giữa Vt cao (12mL/kg) và Vt thấp (6mL/kg). Do đó, cài đặt Vt theo AP có thể cho phép giảm hơn nữa Vt khi nó tạo ra căng phổi quá mức. Tương tự, cho phép Vt cao hơn ở những bệnh nhân có độ đàn hồi thấp có thể tạo điều kiện thuận lợi cho việc thở tự nhiên và giảm thiểu nhu cầu dùng thuốc an thần [5]. Tuy nhiên, cho đến nay, chưa có nghiên cứu lâm sàng nào tập trung vào kết cục lâm sàng để đánh giá chắc chắn hiệu quả của việc chuẩn Vt đối với AP mục tiêu.
Tần số làm căng phồng phổi do khí lưu thông cũng có thể góp phần vào VILI. Tuy nhiên, dữ liệu gần đây đã cho thấy tác động của việc giảm AP đối với việc giảm tỷ lệ tử vong mạnh hơn bốn lần so với tác động của việc giảm tần số hô hấp (RR) [6]. Nói cách khác, giảm AP xuống 1 cmH2O có khả năng là có lợi nếu không tăng RR thêm 4 nhịp thở/phút trở lên vì nhiễm toan hô hấp. Trong trường hợp này, trong điều kiện đẳng trương CO2 (isocapnic[3]), hiệu ứng tổng thể sẽ là vô giá trị. Như thế, các tác động có hại của tăng CO2 máu, như tăng nguy cơ suy thất phải, nên được cân nhắc với việc cải thiện thông khí phút bằng cách tăng RR.
Đo áp lực đẩy thế nào ngay tại giường?
Trong quá trình thở máy có kiểm soát, không có sự không đồng bộ, AP có thể được tính toán dễ dàng trong điều kiện bán tĩnh bằng cách thực hiện tạm dừng ngắn thì hít vào 0,2 – 0,3 giây để đo Pplat. Ở bệnh nhân ARDS, AP an toàn có khả năng < 15 cmH2O [1].
Ở những bệnh nhân thở máy có nhịp thở tự nhiên, phép đo tương tự có thể được thực hiện bằng cách sử dụng thuốc an thần tác dụng ngắn (các dấu hiệu khó nhận biết của việc kích hoạt (triggering) nghịch đảo phải được xem xét cẩn thận và tránh). Nếu công hít vào vẫn còn, có thể sử dụng thuốc giãn cơ tác dụng ngắn. Sau đó, đo Pplat và tổng PEEP và Crs có thể được tính toán. Khi phép đo này được thực hiện, biết được Vt của nhịp thở theo nhịp thở, chúng ta có thể nhanh chóng biết được lượng AP mà bệnh nhân thực hiện ở mỗi lần hít vào (AP = Vt/Crs) (Hình 1A và B).
Theo cách khác, nếu chúng ta muốn tránh dùng thuốc an thần, chúng ta có thể ước tính hợp lý AP bằng một số thủ thuật đơn giản và thực tế được mô tả gần đây. Điều đầu tiên được đòi hỏi là làm tắc nghẽn cuối thì hít vào trong quá trình thở tự nhiên ở những bệnh nhân có sự dãn cơ hô hấp hoàn toàn (chủ yếu có giá trị đối với thông khí hỗ trợ áp lực). Ở những bệnh nhân này, phép đo áp lực đường thở ổn định sẽ được thu nhận Áp lực đẩy thu được bằng cách giữ ở cuối thì hít vào trong thở PSV có liên quan với tỷ lệ tử vong trong một nghiên cứu [7] và có thể được tính đơn giản bằng
Pplat trừ PEEP (Hình 1C), mặc dù Pplat có thể khó đo ở những bệnh nhân có sức cơ hô hấp khỏe mạnh và công thở ra hiệu quả [8] (Hình 1D). Thủ thuật này đòi hỏi kiểm tra trực quan các đường biểu diễn của đường thở. Các đường biểu diễn của Pplat không ổn định nên bị loại bỏ [9], nhưng chúng không thường thư thế.
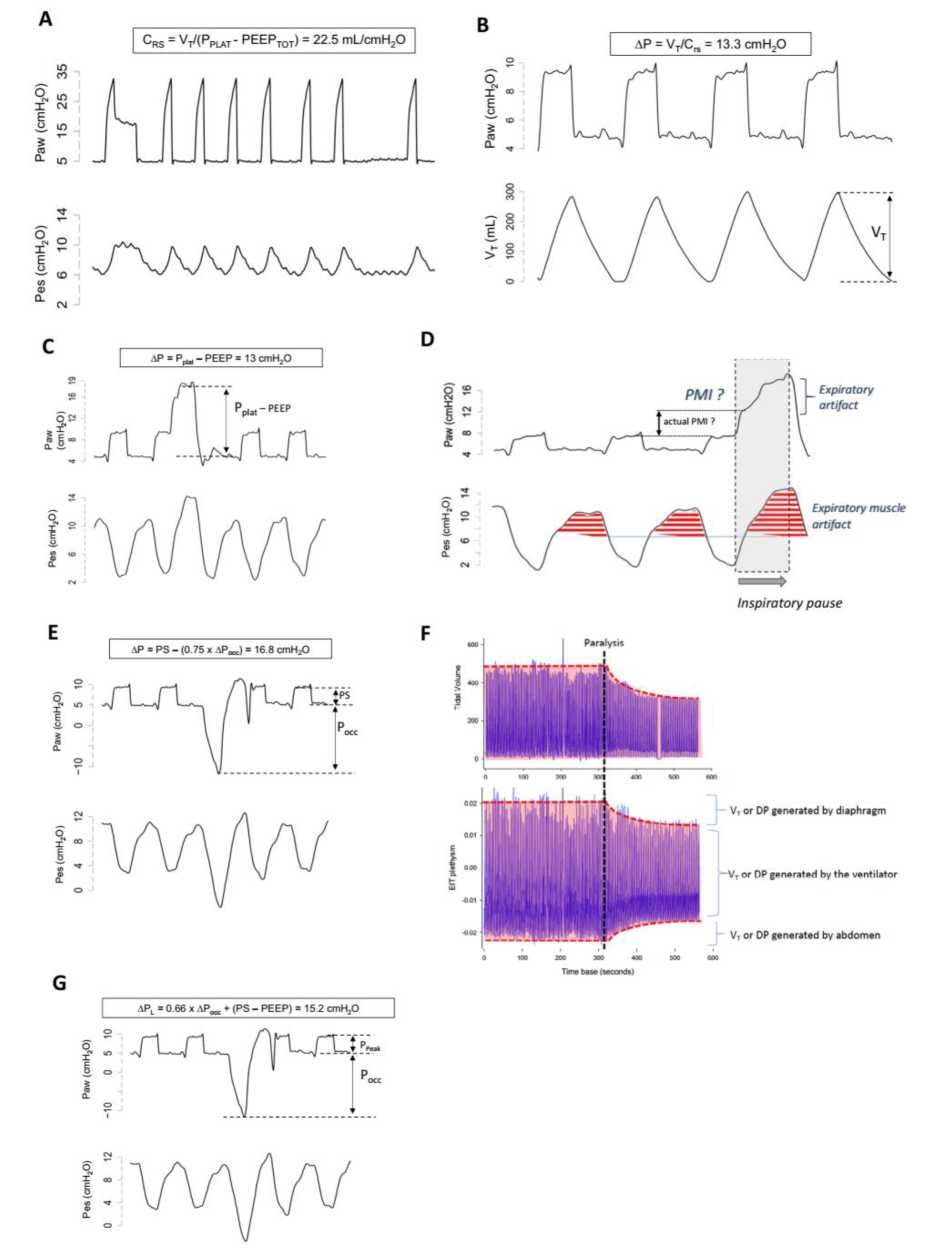
Đường biểu diễn tiêu biểu của áp lực đoạn gần và thực quản thu được từ một bệnh nhân tại các thời điểm khác nhau. Bệnh nhân được thông khí hỗ trợ áp lực và sau đó được gây liệt cơ bằng succinylcholine (bảng A). Bệnh nhân được theo dõi với phép đo thể tích bằng chụp cắt lớp trở kháng điện (EIT – electrical impedance tomography plethysmograph) và trong quá trình gây liệt, chúng tôi đảm bảo thông khí phút giống như trong quá trình thông khí hỗ trợ áp lực. Chúng tôi cũng đảm bảo rằng EELZ (biểu thị cho EELV) không thay đổi đáng kể, để hoạt động ở cùng một thể tích phổi tổng thể, với các cơ chế tương tự của hệ thống hô hấp. Sau khi thực hiện tạm dừng thở vào và thở ra ngắn (0,5 giây), chúng tôi đã đo độ giãn nở bán tĩnh và áp suất đẩy (lần lượt là 22,5mL/cmH2O và 13,3 cmH2O). Trong bảng B, bệnh nhân được thông khí hỗ trợ áp lực được đặt ở mức 5cmH2O, khi chúng tôi đo Vt = 300 mL. Khi đó AP được tính là Vt/Crs = 300/22,5 = 13,3cmH2O. Lưu ý rằng chúng tôi đảm bảo rằng Vt ở bảng A giống với Vt ở bảng B. Trong bảng C, bệnh nhân cũng được thông khí hỗ trợ áp lực đặt ở mức 5cmH2O và sau đó chúng tôi thực hiện tạm dừng thì hít vào. Chú ý rằng áp lực đường thở tăng đáng kể trong thời gian tạm dừng, cho thấy công tiềm ẩn mà bệnh nhân đã thực hiện trong thì hít vào trước khi tiến hành tạm dừng (lúc này được chuyển thành áp lực nảy đàn hồi). Lưu ý rằng sự dao động âm của áp lực thực quản diễn ra đều đặn xuyên suốt các chu kỳ với hầu như không bị sự tác động của thao tác. AP sau đó được tính là Pplat – PEEP = 13cmH2O (cho thấy sự ước tính thấp hơn không đáng kể). Trong bảng D, chúng ta có thể quan sát tác động của hoạt động cơ thở ra trong quá trình tạm dừng hít vào tạo ra sự gia tăng liên tục áp lực đường thở trong quá trình tạm dừng thì hít vào. Các cơ thở ra được kích hoạt trong mỗi nhịp thở (chúng ta có thể nhận ra điều này bằng cách so sánh với áp lực thực quản khi gây liệt). Hơn nữa, có một phản ứng rõ ràng của sự co cơ thở ra mạnh hơn đối với thao tác. Trong bảng E, bệnh nhân vẫn được thông khí hỗ trợ áp lực được đặt ở mức 5cmH2O, và sau đó chúng tôi thực hiện tạm dừng thì thở ra. Lưu ý rằng áp suất đường thở giảm đáng kể trong thời gian tạm dừng, với độ lớn tương tự như giảm áp suất thực quản (được gọi là Pocc, = -15,7cmH2O), cho thấy công dự kiến sẽ được thực hiện trong hơi thở tiếp theo. Chú ý rằng dao động âm của áp lực thực quản cao hơn một chút trong nhịp thở bị tắc nghẽn, khi so sánh với những nhịp thở trước đó. Điều này được giải thích bởi hệ số K (0,75) sử dụng trong phép tính này: AP = PS – (0,75 X Pocc) = 5 – (0,75 X -15,7) = 16,8cmH2O. Phương pháp này mô tả AP động, ước tính cao hơn phương pháp trước đó ~ 3,8cmH2O. Phần lớn của sự ước tình cao hơn này là do các lực kháng không được trừ ra khỏi áp lực đường thở/cơ khi sử dụng phương pháp này. Trong bảng F, chúng ta có thể quan sát Vt và phép đo thể tích bằng chụp cắt lớp trở kháng điện (EIT) trước và sau gây liệt (đường chấm đen). Như chúng ta có thể quan sát, trước khi gây liệt, lượng AP và Vt được tạo ra là tổng của sự dãn các cơ thở ra, máy thở và công hít vào. Sau khi gây liệt, AP và Vt được tạo ra chỉ phụ thuộc vào máy thở vì hoạt động cơ hoàn toàn bị loại bỏ. Trong bảng G, chúng tôi đã sử dụng cùng đường biễu diễn và tạm dừng thì thở ra như trong bảng E. Nhưng chúng tôi đã sử dụng nó để tính toán AP xuyên phổi động (APL). Trong trường hợp này, hệ số 0,66 về thực chất đã trừ đi thành phần thành ngực liên quan đến tất cả các tính toán trước đó. Tuy nhiên, nó ước tính quá cao các phương pháp B và C vì nó không trừ đi các lực cản như trong phương pháp D. Chúng ta có thể giả định rằng nó biểu thị cho mức đỉnh của căng phổi động trong quá trình thở tự nhiên. Các nghiên cứu xác nhận mức độ an toàn cho biến số này đang được tiến hành.
Phương pháp thứ ba có thể được sử dụng để ước tính “AP động”, bao gồm các lực kháng được tạo ra trong thì hít vào, dẫn đến việc ước tính AP cao hơn một chút, do đó được gọi là AP động. Trong trường hợp này, chúng ta thực hiện tạm dừng ở thì thở ra và để bệnh nhân tự thở. Sự dao động áp lực đường thở được tạo ra bởi công hít vào của bệnh nhân khi đường thở bị tắc nghẽn (APocc) có thể được sử dụng để ước tính thành phần của AP động được tạo ra bởi các cơ hít vào (Pmusc) trong các nhịp thở không bị tắc nghẽn: Pmusc = – 0,75 X Pocc. Pocc được nhân với 0,75 để ước tính Pmusc, giải thích cho sự khác biệt của các lực được tạo ra trong quá trình co cơ bán tĩnh so với bán đẳng trương (một hàm của mối quan hệ lực – vận tốc của cơ hoành). Hệ số hiệu chỉnh này có được từ thực nghiệm và được xác nhận trong nghiên cứu đầu tiên mô tả việc sử dụng Pocc [10]. Thành phần máy thở của AP được tính gần đúng bằng mức hỗ trợ áp lực được cài đặt cao hơn mức PEEP (hoặc áp lực đỉnh cao hơn mức PEEP) (Hình 1E).
APdyn = PSVset – (0.75 X APocc)
Xét đến thành phần lực kháng về bản chất đã được thêm vào công thức tính này, các giá trị AP động được tính theo phương pháp này cần nên chú ý bất cứ lúc nào khi vượt quá 3 – 5cmH2O giá trị ước tính từ phương pháp thứ hai (tạm dừng thì hít vào). Trong trường hợp này, hoạt động của cơ thở ra bị nghi ngờ và phương pháp đầu tiên có thể được sử dụng để có được phép đo AP đáng tin cậy hơn. Hơn nữa, do sự thư giãn của các cơ thở ra làm tăng Vt (tương ứng với thể tích đi theo sự phục hồi áp suất xuyên phổi khi kết thúc thở ra), hoạt động thở ra này tạo ra sự gia tăng thực sự của AP (Hình 1F)
Cuối cùng, phép đo Pocc cũng đã được xác nhận trong nhiều nghiên cứu [10, 11] để ước tính áp lực đẩy xuyên phổi động (APLdyn) như là chỉ số ước tính cho tình trạng căng phổi, nghĩa là thành phần của AP chỉ sử dùng để làm căng phồng phổi và cũng bao gồm các lực kháng để di chuyển khí qua đường thở và nội khí quản (ET) (Hình 1G):
APLdyn = (Ppeak – PEEP) – (0.66 X APocc)
Các phương pháp dựa trên Pocc có thể ước tính quá cao (overestimate) áp lực căng phổi tĩnh do các lực kháng cần thiết để di chuyển khí qua đường thở và nội khí quản. Tuy nhiên, trước đây đã gợi ý áp lực động (hơn là áp lực tĩnh) có thể phù hợp hơn trong quá trình thở tự nhiên khi có thông khí hỗ trợ do sự thay đổi theo vùng của áp lực căng phổi trong điều kiện động, theo hiện tượng pendelluft [12]. Giới hạn trên chính xác của các giá trị được chấp nhận vẫn đang được xác định. Tuy nhiên, các nghiên cứu gần đây đã nhắm mục tiêu giá trị của APLdyn nằm trong khoảng từ 15 – 20cmH2O [11, 13], nhưng cần có nhiều nghiên cứu hơn để xác định ngưỡng này. Khi sử dụng bất kỳ phương pháp nào trong số này trong thực hành lâm sàng hàng ngày, nếu không thể đo được tổng PEEP thì mức PEEP cài đặt sẽ được sử dụng để tính toán AP.
Làm thế nào để kiểm soát áp lực đẩy ở bệnh nhân thở tự nhiên?
Bệnh nhân thở tự nhiên với điều hòa hoạt động hô hấp thích hợp đáp ứng với những thay đổi về hỗ trợ áp lực, có nghĩa là sự gia tăng hỗ trợ áp lực sẽ liên quan đến việc giảm đáng kể công hít vào, dẫn đến kiểm soát AP tốt hơn. Tuy nhiên, việc kiểm soát AP ở những bệnh nhân có điều hòa hoạt động hô hấp không phù hợp sẽ khó khăn hơn vì nó không đáp ứng với những thay đổi về hỗ trợ áp lực, công hít vào không thay đổi bất kể sự gia tăng hỗ trợ áp lực và do đó, tạo ra AP cao hơn. Một số bệnh nhân này có thể đáp ứng với việc tăng mức PEEP bằng cách ức chế điều hòa hoạt động hô hấp do phản xạ Hering-Breuer [13, 14]. Thúc đẩy gây nhiễm kiềm nhẹ và tăng FiO2 để đạt mức PaO2 bình thường có thể là có lợi.
Ngoài ra, một phân tích mô phỏng được thực hiện trên một nhóm bệnh nhân ARDS cho thấy việc loại bỏ carbon dioxide bằng các kỹ thuật ngoài cơ thể cũng có thể có lợi [13] ở những bệnh nhân có tỷ lệ khoảng chết phế nang cao hơn hoặc Crs thấp hơn và những bệnh nhân được điều trị với các phương pháp loại bỏ CO2 cao hơn [15]. Tuy nhiên, giả thiết này nên được thử nghiệm trong các nghiên cứu trong tương lai. Cuối cùng, nếu không có biện pháp nào trong số này hiệu quả, có thể phải sử dụng thuốc an thần cho bệnh nhân. Trong trường hợp này, thuốc an thần tác dụng ngắn có thể là thuốc được ưu tiên. Nếu không thể hạn chế AP bằng các chiến lược này, thì việc phong tỏa thần kinh cơ một phần cũng có thể tạo điều kiện thuận lợi cho việc thông khí bảo vệ phổi ở những bệnh nhân được dùng thuốc an thần, làm giảm APL và công thở [13, 16].
Hạn chế
Về mặt đánh giá nguy cơ VILI, ở góc độ sinh lý, chúng ta nên đo APL. Tuy nhiên, chúng ta nên đo AP thường xuyên hơn vì nó dễ dàng hơn để thực hiện tại giường. Hơn nữa, kết quả của một nghiên cứu quan sát lớn gần đây bao gồm các bệnh nhân ARDS cho thấy APL không cải thiện dự đoán tử vong trong 60 ngày so với AP [17]. Kết quả này cho thấy áp lực đẩy thành ngực cũng có thể liên quan đến mức độ nặng và kết cục của bệnh. Từ quan điểm thực tế, giả sử rằng độ giãn nở của thành ngực không thay đổi đáng kể trong quá trình chăm sóc tại ICU, sự khác biệt về AP có thể phản ánh những thay đổi trong APL.
Tóm lại, AP có thể là biến đơn mạnh nhất liên quan đến tỷ lệ tử vong ở bệnh nhân ARDS vì nó liên quan đến cả mức độ nặng của bệnh và cài đặt máy thở. Trong thời đại y học cá thể hóa, một số đo Vt đơn độc không phù hợp với tất cả. Áp lực đẩy có thể giúp chuẩn Vt theo mức độ hoạt động của phổi và có khả năng cải thiện kết cục. Tuy nhiên, cách tiếp cận này cần được thử nghiệm trong các nghiên cứu ngẫu nhiên được thiết kế chuyên biệt.
TÀI LIỆU THAM KHẢO
- Amato MB, Meade MO, Slutsky AS, Brochard L, Costa EL, Schoenfeld DA, Stewart TE, Briel M, Talmor D, Mercat A, Richard JC, Carvalho CR, Brower RG (2015) Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med 372:747-755
- Gattinoni L, Pesenti A, Avalli L, Rossi F, Bombino M (1987) Pressure-volume curve of total respiratory system in acute respiratory failure. Computed tomographic scan study. Am Rev Respir Dis 136:730-736
- Chen L, Jonkman A, Pereira SM, Lu C, Brochard L (2021) Driving pressure monitoring during acute respiratory failure in 2020. Curr Opin Crit Care 27:303-310
- Roca O, Penuelas O, Muriel A, García-de-Acilu M, Laborda C, Sacanell J, Riera J, Raymondos K, Du B, Thille AW, Rios F, Gonzalez M, Del-Sorbo L, Del Carmen MM, Soares MA, Pinheiro BV, Nin N, Maggiore SM, Bersten A, Amin P, Ọakar N, Suh GY, Abroug F, Jibaja M, Matamis D, Zeggwagh AA, Sutherasan Y, Anzueto A, Esteban A, Frutos-Vivar F (2021) Driving pressure is a risk factor for ARDS in mechanically ventilated subjects without ARDS. Respir Care 66:1505-1513
- Goligher EC, Costa ELV, Yarnell CJ, Brochard LJ, Stewart TE, Tomlinson G, Brower RG, Slutsky AS, Amato MPB (2021) Effect of lowering tidal volume on mortality in ARDS varies with respiratory system elastance. Am J Respir Crit Care Med 203:1378-1385
- Costa ELV, Slutsky A, Brochard LJ, Brower R, Serpa-Neto A, Cavalcanti AB, Mercat A, Meade M, Morais CCA, Goligher E, Carvalho CRR, Amato MBP (2021) Ventilatory variables and mechanical power in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. https:// doi. org/ 10. 1164/ rccm. 202009- 3467OC
- Bellani G, Grassi A, Sosio S, Gatti S, Kavanagh BP, Pesenti A, Foti G (2019) Driving pressure is associated with outcome during assisted ventilation in acute respiratory distress syndrome. Anesthesiology 131:594-604
- Bellani G, Grassi A, Sosio S, Foti G (2019) Plateau and driving pressure in the presence of spontaneous breathing. Intensive Care Med 45:97-98
- Bianchi I, Grassi A, Pham T, Telias I, Teggia Droghi M, Vieira F, Jonkman A, Brochard L, Bellani G (2022) Reliability of plateau pressure during patient-triggered assisted ventilation. Analysis of a multicentre database. J Crit Care 68:96-103
- Bertoni M, Telias I, Urner M, Long M, Del Sorbo L, Fan E, Sinderby C, Beck J, Liu L, Qiu H, Wong J, Slutsky AS, Ferguson ND, Brochard LJ, Goligher EC (2019) A novel non-invasive method to detect excessively high respiratory effort and dynamic transpulmonary driving pressure during mechanical ventilation. Crit Care 23:346
- de Vries HJ, Tuinman PR, Jonkman AH, Liu L, Qiu H, Girbes ARJ, Zhang Y, de Man AME, de Grooth HJ, Heunks L (2023) Performance of noninvasive airway occlusion maneuvers to assess lung stress and diaphragm effort in mechanically ventilated critically ill patients. Anesthesiology 138:274-288
- Yoshida T, Amato MBP, Kavanagh BP (2018) Understanding spontane-ous vs. ventilator breaths: impact and monitoring. Intensive Care Med 44:2235-2238
- Dianti J, Fard S, Wong J, Chan TCY, Del Sorbo L, Fan E, Amato MBP, Granton J, Burry L, Reid WD, Zhang B, Ratano D, Keshavjee S, Slutsky AS, Brochard LJ, Ferguson ND, Goligher EC (2022) Strategies for lung- and diaphragm-protective ventilation in acute hypoxemic respiratory failure: a physiological trial. Crit Care 26:259
- Haberthur C, Guttmann J (2005) Short-term effects of positive end-expiratory pressure on breathing pattern: an interventional study in adult intensive care patients. Crit Care 9:R407- 415
- Goligher EC, Combes A, Brodie D, Ferguson ND, Pesenti AM, Ranieri VM, Slutsky AS (2019) Determinants of the effect of extracorporeal carbon dioxide removal in the SUPERNOVA trial: implications for trial design. Intensive Care Med 45:1219-1230
- Doorduin J, Nollet JL, Roesthuis LH, van Hees HW, Brochard LJ, Sinderby CA, van der Hoeven JG, Heunks LM (2017) Partial neuromuscular block-ade during partial ventilatory support in sedated patients with high tidal volumes. Am J Respir Crit Care Med 195:10331042
- Chen L, Grieco DL, Beloncle F, Chen GQ, Tiribelli N, Madotto F, Fredes S, Lu C, Antonelli M, Mercat A, Slutsky AS, Zhou JX, Brochard L (2022) Parti-tion of respiratory mechanics in patients with acute respiratory distress syndrome and association with outcome: a multicentre clinical study. Intensive Care Med 48:888-898