TIẾP CẬN QUẢN LÝ TOÀN DIỆN VIÊM GAN B MẠN – “bài tổng hợp các khuyến cáo mới nhất về viêm gan B dựa trên các hiệp hội gan mật” của Bs Huỳnh Văn Trung- Nội tiêu hoá gan mật – Trung tâm Nội soi và phẫu thuật nội soi tiêu hoá – Bệnh viện Tâm Anh TPHCM.
CHỈ ĐỊNH ĐIỀU TRỊ VIÊM GAN B MẠN- “Hội gan mật Hàn Quốc 2022”
Kháng virus không chỉ định ở bệnh nhân viêm gan B mạn giai đoạn dung nạp miễn dịch với HBeAg (+), HBV DNA >10^7 IU/ml, ALT bình thường, không viêm hoặc xơ hóa gan (B1)
Sinh thiết gan có thể được xem xét ở bệnh nhân viêm gan B mạn HBeAg (+) với ALT bình thường nhằm quyết định liệu pháp kháng virus nếu bệnh nhân ≥ 30-40 tuổi, HBV DNA < 10^7 IU/ml và test không xâm lấn gợi ý xơ hóa gan đáng kể hoặc ALT gần giới hạn trên (B2)
Kháng virus được khuyến cáo ở bệnh nhân viêm gan B mạn HBeAg (+) với HBV DNA ≥20.000IU/ml hoặc HBeAg (-) với HBV DNA ≥ 2000IU/ml NẾU ALT ≥ 2 ULN (giới hạn trên của chỉ số bình thường, 34 IU/ml/nam và 30 IU/ml/nữ) (A1)
Trong trường hợp ALT từ 1-2 ULN (giới hạn trên bình thường) => theo dõi sát ALT hoặc sinh thiết gan được xem xét => kháng virus được khuyến cáo nếu sinh thiết gan với xơ hóa/ viêm hoại tử mức độ trung bình- nặng (≥ F2). (A1)
Test đánh giá xơ hóa gan không xâm lấn có thể thay thế nếu sinh thiết gan không có (B1)
Bệnh nhân viêm gan B mạn HBeAg (+) hoặc HBeAg (-) => liệu pháp kháng virus ngay trong các trường hợp bùng phát virus với ALT ≥ 5-10 ULN, dấu hiệu suy gan như: vàng da, PT kéo dài, báng bụng, bệnh não gan (A1)
Bệnh nhân viêm gan B mạn HBeAg (-) với HBV DNA ≥ 2000 IU/ml, ALT bình thường => theo dõi được khuyến cáo. Có thể xem xét sinh thiết gan hoăc đánh giá xơ hóa với test không xâm lấn (B2)
Kháng virus không được khuyến cáo ở bệnh nhân viêm gan B mạn giai đoạn không hoạt động miễn dịch với HBV DNA < 2000/ml, ALT bình thường không bằng chứng xơ hóa gan (B1)
Bệnh nhân xơ gan còn bù => kháng virus được khuyến cáo bất chấp nồng độ ALT nếu HBV DNA ≥ 2000 UI/ml (A1)
Kháng virus cũng được xem xét ở bệnh nhân xơ gan còn bù nếu HBV DNA phát hiện và nhỏ hơn 2000 UI/ml, bất kể nồng độ ALT (B1)
Bệnh nhân xơ gan mất bù => NAs được khuyến cáo nếu HBV DNA phát hiện, bất kể nồng độ ALT và ghép gan cũng được xem xét (A1)
CHỈ ĐỊNH ĐIỀU TRỊ, PHÒNG NGỪA VÀ THEO DÕI- “Hội gan mật Trung Quốc 2022”
Bệnh nhân viêm gan B mạn với HBV DNA (+) => liệu pháp kháng virus được chỉ định nếu ALT tăng kéo dài (>ULN) và các nguyên nhân tăng ALT khác được loại trừ. Các nguyên nhân tăng ALT có thể gặp như: nhiễm trùng, thuốc, viêm gan do rượu, viêm gan nhiễm mỡ không do rượu, tự miễn, bệnh hệ thống ảnh hưởng gan, đồng thời thân trọng trường hợp nồng độ ALT bình thường tạm thời do thuốc (B1)
Bệnh nhân với xơ gan còn bù => liệu pháp kháng virus sẽ được chỉ định nếu HBV DNA (+), bất kể nồng độ ALT và tình trạng HBeAg. Bệnh nhân với xơ gan mất bù => liệu pháp kháng virus được chỉ định nếu HBsAg (+), thậm chí HBV DNA không phát hiện (A1)
Bệnh nhân với HBV DNA (+) và ALT bình thường có nguy cơ cao bệnh tiến triển và liệu pháp kháng virus được chỉ định nếu có bất kỳ tiêu chuẩn sau (1) sinh thiết gan với viêm gan và/ hoặc xơ hóa gan rỏ (≥G2, ≥S2). (2) ALT bình thường kéo dài (test mỗi 3 tháng x 12 tháng) nhưng tiền căn gia định xơ gan hoặc K gan và > 30 tuổi). (3) ALT bình thường kéo dài, không tiền căn gia đình xơ gan hoặc K gan nhưng >30 tuổi và test không xâm lấn hoặc sinh thiết gan cho thấy viêm gan hoặc xơ hóa gan rỏ. (4) triệu chứng ngoài gan liên quan HBV như viêm cầu thận, viêm mạch máu, bệnh thần kinh ngoại biên….(B1)
Bệnh nhân viêm gan B mạn HBeAg (+) được điều trị với entecavir, TDF, TAF. Nếu sau 1 năm nồng độ HBV DNA (-), ALT bình thường, chuyển đổi huyết thanh HBeAg => tiếp tục điều trị ít nhất 3 năm (theo dõi mỗi 6 tháng). Ngưng điều trị nếu HBV DNA vẫn (-), ALT bình thường và mất HBsAg. Điều trị kéo dài có thể giảm nguy cơ tái phát (A1)
Bệnh nhân viêm gan B mạn HBeAg (-) được điều trị với entecavir, TDF, TAF => ngưng liệu pháp được xem xét nếu HBsAg biến mất và HBV DNA (-). (A1)
Bệnh nhân viêm gan B mạn với xơ gan còn bù => điều trị lâu dài với ETV, TDF, or TAF, or peg-lFN-α được khuyến cáo. Tác dụng phụ của peg-lFN-α được theo dõi sát (A1)
Bệnh nhân viêm gan B mạn với xơ gan mất bù => điều trị lâu dài với ETV và TDF được khuyến cáo. TAF là lựa chọn thay thế nếu cần thiết (C1)
Bệnh nhân viêm gan B mạn được điều trị với ETV, TDF hoặc TAF, sau 48 tuần nếu nồng độ HBV DNA >2×10^3 IU/ml => thay đổi chế độ điều trị và đánh giá tình trạng tuân thủ thuốc, nếu bệnh nhân sử dụng ETV sẽ được chuyển sang TDF hoặc TAF, nếu dùng TDF hoặc TAF sẽ chuyển sang ETV đơn độc hoặc kết hợp thêm ETV. (C2). Liệu pháp Peg-IFN-α sẽ được sử dụng kết hợp (B1)
Bệnh nhân viêm gan B mạn với xơ gan được điều trị với ETV, TDF hoặc TAF, sau 24 tuần nếu nồng độ HBV DNA >2×10^3 IU/ml => thay đổi chế độ điều trị và đánh giá tình trạng tuân thủ thuốc, nếu bệnh nhân sử dụng ETV sẽ được chuyển sang TDF hoặc TAF, nếu dùng TDF hoặc TAF sẽ chuyển sang ETV đơn độc hoặc kết hợp thêm ETV. (C2).
Tất cả bệnh nhân trải qua hóa trị hoặc liệu pháp ức chế miễn dịch sẽ được tầm soát HBsAg và anti HBc (A1). Bệnh nhân HBsAg (+) => liệu pháp kháng virus sẽ được khởi động trước 1 tuần hoặc khi bệnh nhân nhận hóa tri hoặc liệu pháp ức chế miễn dịch (A1). Và ETV, TDF hoặc TAF được sử dụng (B1).
Bệnh nhân mong muốn mang thai khi đang điều trị viêm gan B mạn hoặc bệnh nhân có chỉ định liệu pháp kháng virus khi đang mang thai => TDF được sử dụng (B1)
Nếu nồng độ HBV DNA >200.000 UI/ml trong tam cá nguyệt thứ 2 và 3 thai kỳ => tư vấn bệnh nhân nguy cơ lây truyền và khởi liệu pháp kháng virus với TDF hoặc LdT từ tuần 24-28 thai kỳ (A1). Phụ nữ mang thai ở giai đoạn dung nạp miễn dịch sẽ được ngưng kháng virus ngay sau sinh hoặc sau 1-3 tháng điều trị. Bú sữa mẹ không là chống chỉ định khi sử dụng TDF (C2). Xét nghiệm chức năng gan, HBV DNA được kiểm tra mỗi 3-6 tháng sau ngưng thuốc => nếu bệnh nhân phát triển viêm gan bùng phát sẽ được khởi động kháng virus ngay lập tức (A2)
Bệnh nhân nhiễm HBV mạn với bệnh thận mạn, suy giảm chức năng thận hoặc đang điều trị thay thế thận => ETV và TAF là lựa chọn đầu tiên, LdT là lựa chọn thay thế. ADV và TDF không được khuyến cáo (B1).
Bệnh nhân với viêm gan B mạn và C mạn đồng mắc, khi liệu pháp DAA được sử dụng điều trị HCV => Liệu pháp NA (ETV, TDF, hoặc TAF) sẽ được bắt đầu nhằm ngăn ngừa viêm gan B tái hoạt động nếu HBsAg (+) và sẽ được ngưng sau liệu pháp DAA 12 tuần (B2).
Bệnh nhân nhiễm HBV mạn với HBsAg (-) và anti HBc (+) có nguy cơ tái hoạt động HBV => trong thời gian điều trị với DAA theo dõi HBV DNA và HBsAg mỗi tháng, nếu HBsAg (+) => khởi động liệu pháp NA (ETV, TDF, hoặc TAF)
Bệnh nhân nhiễm HBV cấp, bán cấp, cấp/mạn hoặc suy gan B mạn => liệu pháp NA (ETV, TDF, hoặc TAF) được khuyến cáo nếu HBsAg (+) (A1). Tiên lượng tốt nếu HBV DNA giảm 2 lg IU/mL trong 2-4 tuần.
Bệnh nhân nhiễm HBV mạn với HCC => liệu pháp NA (ETV, TDF, hoặc TAF) được khuyến cáo nếu HBsAg (+) (A1).
Bệnh nhân HCC với HBsAg (+) nhưng HBV DNA (-) vẫn có nguy cơ tái hoạt động HBV khi trải qua cắt gan, TACE, xạ trị hoặc hóa trị.
Bệnh nhân nhiễm HBV mạn trải qua ghép gan => liệu pháp NA (ETV, TDF, hoặc TAF) được khuyến cáo nếu HBsAg (+) (A1).
Các yếu tố ảnh hưởng đến nguy cơ tái phát sau khi ngưng liệu pháp nucleos(t)ide analogues (NAs)
Chủng tộc và genotype HBV: có vài sự khác nhau giữa chủng tộc u- Á về nguy cơ tái phát sau khi ngưng NAs, tuy nhiên cần thêm nhiều nghiên cứu và so sánh.
Thời gian điều trị và loại NAs: phân tích gộp cho thấy thời gian điều trị với HBV DNA < 2000 IU/ml (hoặc không phát hiện) <24 tháng trước khi ngưng NAs có tỉ lệ tái điều trị cao hơn soi với thời gian > 24 tháng. Chưa có sự thống nhất về loại NAs hiệu quả nhất trong việc ngăn ngừa tái phát sau ngưng thuốc, cần nghiên cứu thêm
Nồng độ HBsAg lúc ngưng điều trị: nồng độ HBsAg lúc ngưng NAs càng thấp nguy cơ tái phát càng thấp, tuỳ theo chủng tộc có sự khác biệt về ngưỡng nồng độ HBsAg. Ở Châu u HBsAg <1000 IU/ml, ở Châu Á HBsAg <100 IU/ml được xem xét khi ngưng NAs
Hepatitis B core-related antigen (HBcrAg). Hướng dẫn sử dụng nồng độ HbcrAg dự đoán nguy cơ sau ngưng NAs được khuyến cáo bởi Hội gan mật Nhật Bản (Japan Society of Hepatology). Ở bệnh nhân HbeAg (-) đáp ứng điều trị NAs ít nhất 2 năm với HBsAg levels < 1.9 log10 IU/mL và HBcrAg levels < 3.0 log10 IU/mL có nguy cơ tái phát thấp sau ngưng điều trị
Nồng độ HBV-RNA huyết thanh thấp cho thấy nguy cơ tái phát HBV thấp, tuy nhiên nồng độ này chưa được đánh giá bởi các nghiên cứu tiến cứu, Cut-off HBV RNA cũng chưa được thống nhất
Tiêu chuẩn tái điều trị cho bệnh nhân HBeAg (-) sau ngưng NAs: điều trị NAs sẽ được tái khởi động ngay lập tức khi có ít nhất 1 trong các tiêu chuẩn sau
Tăng bilirubin trực tiếp và tăng ALT (được khẳng định 2 lần liên tiếp ở trung tâm xét nghiệm đạt chuẩn)
PT tăng thêm >=2s và tăng ALT
Tăng ALT gấp 10 ULN (giới hạn trên của chỉ số bình thường), có hay không có triệu chứng
Tăng ALT 2× ULN và ≤ 5× ULN kéo dài ≥ 84 days (12 weeks) cũng như tái phát HBV-DNA ≥ 20,000 copies/mL
Tăng ALT 5× ULN và ≤ 10× ULN kéo dài ≥ 28 days (4 weeks)
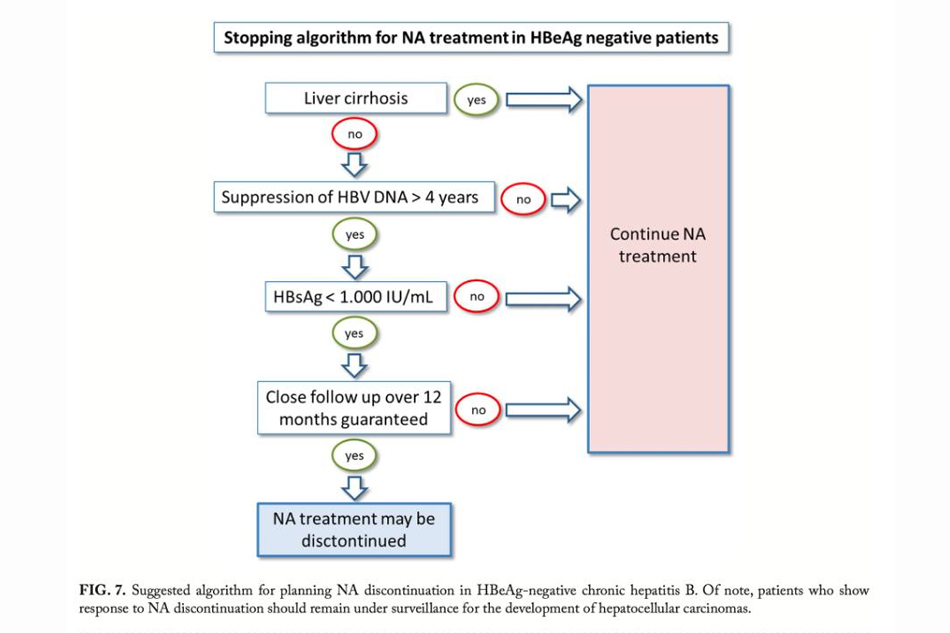
Khi nào ngưng NAs và theo dõi như thế nào? Khi xem xét ngưng điều trị NAs cần đánh giá và trả lời các câu hỏi sau?
Bệnh nhân có xơ gan không? Nếu có chắc chắn không ngưng.
Nồng độ HBV DNA <2000 Iu/ml hoặc không phát hiện kéo dài bao lâu? Tốt nhất trên 24 tháng, tối ưu > 4 năm trong thời gian điều trị.
Nồng độ HBsAg bao nhiêu? <1000 IU/ml nếu chủng tộc châu u và <100 Iu/ml nếu chủng tộc Á châu.
QUẢN LÝ VIÊM GAN B MẠN KHÁNG THUỐC- AASLD 2018
Entecavir, TDF, and TAF là 3 thuốc có tỉ lệ kháng thuốc thấp nhất ở bệnh nhân chưa điều trị NAs trước đây, trong khi đó tenofovir (TDF or TAF) là 2 thuốc có tỉ lệ kháng thấp nhất ở bệnh nhân đã từng được điều trị NAs.
Bùng phát virus được xác đinh khi nồng độ HBV DNA tăng > 1log 10 (gấp 10 lần) so với mức thấp nhất sau khi đã đáp ứng virus trước đó. Bùng phát virus thường kèm theo bùng phát sinh hóa (tăng ALT trong quá trình điều trị sau khi đã đáp ứng sinh hóa).
Tenofovir disoproxil fumarate đơn trị liệu hiệu quả ở bệnh nhân đề kháng lamivudine-, adefovir-, or entecavir và là liệu pháp cứu vãn đặc biệt ở bệnh nhân có tiền sử sữ dụng NAs không rỏ loại.
Entecavir đơn trị liệu có tỉ lệ đề kháng sau 5 năm # 1%, ở bệnh nhân kháng lamivudine tỉ lệ kháng entecavir sau 5 năm cao # 50%. Mặc dù dùng entecavir liều cao (1 vs. 0.5 mg daily) giảm tỉ lệ đề kháng nhưng ưu tiên kết hợp lamivudine và adefovir or tenofovir đơn trị liệu hơn.
Entecavir được sử dụng ở bệnh nhân đề kháng adefovir- or tenofovir (đề kháng tenofovir rất hiếm). Entecavir không chỉ định ở bệnh nhân đề kháng lamivudine or telbivudine bởi vì nguy cơ cao kháng entecavir.
Điều trị viêm gan D đồng mắc ở bệnh nhân HBV mạn -(American Association for the study of Liver Diseases: AASLD 2018)
NAs không hiệu quả điều trị HDV => NAs không khuyến cáo cho điều trị nhiễm HDV ở bệnh nhân viêm gan B mạn với nồng độ HBV DNA thấp (<2000 IU/ml) hoặc không phát hiện, trừ khi bệnh nhân xơ gan.
Nồng độ HBV-DNA thay đổi trong suốt quá trình điều trị HDV đồng mắc => theo dõi nếu nồng độ HBV DNA > 2000 IU/ml => điều trị với NAs (entecavir, TDF, or TAF).
Interferon alfa (IFN-alpha) là thuốc duy nhất được chấp thuận điều trị viêm gan D, không có sự khác biệt về hiệu quả giữa pegylated interferon alfa (peg-IFN-alpha)- 2a (180 mg weekly) or – 2b (1.5 mg/kg weekly).
Điều trị thành công khi nồng độ HDV RNA không phát hiện sau 24 tuần hoàn thành liệu pháp (liệu pháp >= 48 tuần AASLD 2013 và >= 12 tháng với AASLD 2018), tỉ lệ từ 23% to 57%.
Ở bệnh nhân không có chỉ định điều trị HBV, kết hợp giữa NA với peg-IFN không làm tăng đáp ứng virus.
Nghiên cứu đa trung tâm HIDIT-1 (Hep-Net-International-DeltaHepatitis-Intervention-Study 1) kết hợp hay không peg-IFN trong 48 tuần với adefovir, cho thấy 40% bệnh nhân không phát hiện HDV-RNA 24 tuần sau kết thúc liệu pháp , nhưng sau thời gian 4.3 năm theo dõi chỉ còn 12% bệnh nhân có HDV RNA không phát hiện.
Đáp ứng virus hoàn toàn được xác định khi mất HBsAg đồng thời HDV RNA không phát hiện kéo dài (rất hiếm xảy ra trong 1 năm điều trị). Thời gian điều trị kéo dài tăng khả năng mất, exp: điều trị peg-IFN kéo dài 5 năm => mất HBsAg 3 of 13 patients (23%).
Đáp ứng virus sớm (không phát hiện HDV RNA sau 24 tuần điều trị) => tăng tỉ lệ đáp ứng điều trị kéo dài. Ngược lại ở bệnh nhân sau 24 tuần điều trị, nồng độ HDV RNA giảm <2-log copies/mL => <5% đáp ứng điều trị kéo dài.
PHÒNG NGỪA VIÊM GAN B TÁI HOẠT ĐỘNG Ở BỆNH NHÂN VỚI LIỆU PHÁP ỨC CHẾ MIỄN DỊCH- Hội gan mật Châu Á Thái Bình Dương- APASL 2021
Nguy cơ tái hoạt động virus B ở bệnh nhân HBsAg dương tính và HBsAg âm tính/ Anti HBc dương tính khi sử dụng ức chế miễn dịch: được phân chia thành nguy cơ thấp (<1%), nguy cơ trung bình (1-10%) và nguy cơ cao (> 10%).
Dữ liệu nghiên cứu từ Nhật Bản và Hồng Kong cho thấy # 45-100% viêm gan B tái hoạt động và #15% suy gan ở bệnh nhân HBsAg (+) trải qua ghép tế bào gốc tạo máu (Hematopoietic stem cell transplantation – HSCT) mà không phòng ngừa kháng virus.
Hai phân tích gộp ở Châu Á Thái Bình Dương cho thấy > 30% nguy cơ viêm gan B tái hoạt động ở bệnh nhân lymphoma với HBsAg (+) được điều trị với rituximab.
Bệnh nhân ung thư vú với HBsAg (+) được hóa trị => nguy cơ viêm gan B tái hoạt động và đợt bùng phát viêm gan B lần lượt 22% và 11%.
Bệnh nhân ung thư với HBsAg (+) được điều trị Steroid => nguy cơ viêm gan B tái hoạt động # 26-72% so với 13-36% ở nhóm bệnh nhân được điều trị với Non-steroid.
Bệnh nhân carcinoma tế bào gan liên quan viêm gan B mạn được TACE => dữ liệu từ Hàn Quốc cho thấy nguy cơ viêm gan B tái hoạt động # 32%.
Bất chấp nồng độ HBV DNA phòng ngừa virus sẽ khởi động 7 ngày trước khi khởi động liệu pháp kháng ung thư hoặc suy giảm miễn dịch.
Entecavir or tenofovir là thuốc được ưu tiên sử dụng.
Phần lớn các nghiên cứu và khuyến cáo: thời gian phòng ngừa nên kéo dài 6-12 tháng sau khi kết thúc liệu pháp. Tỉ lệ tái phát sau 12 tháng vẫn được ghi nhận đặc biệt ở bệnh nhân nhận liệu pháp anti-CD20 antibody (e.g., rituximab).
Ở những bệnh nhân không phòng ngừa kháng virus, HBV DNA sẽ được định lượng mỗi 1-3 tháng, kéo dài 12 tháng.