Bài viết Một cách tiếp cận sinh lý để hiểu vai trò của nỗ lực hô hấp trong sự tiến triển của tổn thương phổi trong nhiễm trùng SARS-CoV-2 được dịch bởi Bác sĩ Đặng Thanh Tuấn từ bài viết gốc: A physiological approach to understand the role of respiratory effort in the progression of lung injury in SARS-CoV-2 infection
Tóm tắt
Suy giảm chức năng phổi trong tuần đầu tiên của COVID-19 đã được quan sát thấy khi bệnh nhân không được hỗ trợ hô hấp đầy đủ. Theo lý thuyết, cơ chế bệnh nhân tự gây ra chấn thương phổi (P- SILI, Patient self-inflicted lung injury) là yếu tố chịu trách nhiệm, nhưng không có dữ liệu thực nghiệm và lâm sàng mạnh mẽ để hỗ trợ điều đó. Với sự hiểu biết hạn chế về P-SILI, chúng tôi mô tả cơ sở sinh lý của P-SILI và chúng tôi đưa ra dữ liệu thực nghiệm để hiểu rõ vai trò của biến dạng (strain) khu trú và không đồng nhất trong tổn thương phổi do tăng công thở.
Ngoài ra, chúng tôi thảo luận về cách tiếp cận hiện tại để hỗ trợ hô hấp cho COVID-19 theo quan điểm này.
Bối cảnh
Đại dịch coronavirus 2 (SARS-CoV2) hội chứng hô hấp cấp tính nặng đã đẩy phản ứng của hệ thống y tế đến khả năng tối đa của nó. Ở nhiều nước, số ca mắc bệnh tăng cao đã vượt quá khả năng sẵn có về cơ sở vật chất, công nghệ và nhân lực ở tất cả các tuyến chăm sóc. Các đơn vị chăm sóc đặc biệt đã quá tải do nhiều ca bệnh nặng trong vài tuần trở lại đây, trong đó suy hô hấp cấp tính (ARF, acute respiratory failure) và hội chứng nguy kịch hô hấp cấp tính (ARDS, acute respiratory distress syndrome) là nguyên nhân chính nhập viện. Thở máy (MV, mechanical ventilation) bảo vệ với thể tích khí lưu thông (Vt, tidal volume) thấp, bao gồm cung cấp Vt thấp sinh lý được điều chỉnh theo trọng lượng cơ thể lý tưởng, hiện là tiêu chuẩn chăm sóc cho bệnh nhân cần hỗ trợ hô hấp xâm lấn, như ARDS vừa và nặng. Sự gia tăng bệnh nhân mắc SARS-CoV2 đã dẫn đến nhu cầu về máy thở cơ học chưa từng có, khiến cả thế giới kinh ngạc vì tình trạng thiếu thiết bị không thể tưởng tượng được chỉ 6 tháng trước. Do nhu cầu cao về MV xâm lấn ở nhiều bệnh viện, máy thở cơ học đã trở thành một nguồn lực khan hiếm hoặc không tồn tại, và các chiến lược hỗ trợ hô hấp khác đã được sử dụng, bao gồm ống thông mũi lưu lượng cao (HFNC, high flow nasal cannula), thông khí không xâm nhập (NIV, non-invasive ventilation), và các thiết bị thay thế khác. Các chỉ định cụ thể cho việc sử dụng chúng chưa được xác định rõ ràng, các hướng dẫn đồng thuận còn gây tranh cãi và chúng thường không được tuân thủ trong thực hành lâm sàng. Nguy cơ nhiễm trùng của nhân viên y tế do quá trình tạo khí dung được cho là chống chỉ định mạnh mẽ đối với HFNC và NIV khi bắt đầu đại dịch, ở một mức độ nào đó, góp phần vào sự thiếu hụt máy thở cơ học xâm lấn. Khi đại dịch lên đến đỉnh điểm, việc sử dụng các thiết bị không xâm lấn trở nên phổ biến. Nghiên cứu thuần tập ở Trung Quốc, Ý và Bắc Mỹ [1-3] cho thấy NIV sử dụng từ 10 đến 30% bệnh nhân, nhưng khi xem xét một trung tâm đơn lẻ và loạt trường hợp nhỏ, tỷ lệ này dao động từ 0 đến 69%. Mặc dù hỗ trợ hô hấp không xâm nhập có thể ngăn chặn MV xâm lấn, nhưng nếu thất bại của phương pháp này có thể dẫn đến bệnh tật và tử vong [4-12]. Một số bệnh nhân sẽ vẫn khó thở, thở tự phát, có hoặc không có hỗ trợ hô hấp. Hiện tại, thông tin gián tiếp cho thấy rằng nỗ lực hô hấp mạnh mẽ và rối loạn điều hòa hô hấp có thể là nguyên nhân thúc đẩy tổn thương phổi, một hiện tượng được gọi là “tổn thương phổi do bệnh nhân tự gây ra” (P-SILI) [13-15].
Khung cơ chế sinh học để khuếch đại tổn thương phổi: stress và strain
Phổi có thể được mô tả như một mạng lưới tiền căng thẳng (pre-stressed network) gồm các phần tử mô nhớt đàn hồi (viscoelastic tissue) bị biến dạng bởi sức căng bề mặt và hoạt động của cơ hô hấp. Đặc tính này cho phép sự biến dạng phụ thuộc vào thời gian khi áp lực tác dụng và trở lại cấu hình ban đầu khi giảm áp lực [16]. Quá trình thở tạo ra hiện tượng biến dạng strain có tính chu kỳ liên tục trong suốt cuộc đời, trong đó áp lực tác dụng là áp lực hít vào (inspiratory pressure). Theo thuật ngữ cơ sinh học, sự biến dạng trong phổi đo được gọi là strain, được định nghĩa là sự thay đổi tương đối về thể tích được chuẩn hóa bởi một thể tích tham chiếu. Đặc tính cơ sinh học này có thể được xác định cho toàn bộ phổi (strain toàn cục) là tỷ số giữa Vt và thể tích tham chiếu, thường là thể tích khí ở cuối quá trình thở ra thụ động và dung tích cặn chức năng (FRC, functional residual capacity). Tương ứng, lực tác dụng lên một đơn vị bề mặt, tạo ra biến dạng của nó, gọi là căng thẳng (stress). Áp lực xuyên phổi tương ứng với stress trong phổi. Strain và stress trong mô phổi có liên quan chặt chẽ với nhau thông qua một mối quan hệ cấu thành (stress = tissue elastance x strain). Cả hai đều được coi là đóng một vai trò quan trọng trong việc khởi phát và phát triển của tổn thương phổi do máy thở (VILI, ventilator induced lung injury). Giá trị cao (phi sinh lý) của strain, được đo bằng biến dạng mô phổi liên quan đến sự thay đổi thể tích, được biết là có hại cho phổi và làm tăng tỷ lệ tử vong ở bệnh nhân ARDS khi đang MV [17]. Thật vậy, kết quả lâm sàng được cải thiện ở bệnh nhân ARDS do Vt thấp hơn tương ứng với việc giảm biến dạng phổi do MV [18]. Những phát hiện thuyết phục và có cơ sở này đã hướng sự chú ý của một số nhóm đến việc tìm hiểu các cơ chế vùng biến dạng ở những bệnh nhân thở máy. Hiểu biết về sự căng thẳng toàn cục trong phổi đã cho phép xác định các ngưỡng Vt an toàn hơn để ngăn ngừa VILI, hiện đã có trong các hướng dẫn và sự đồng thuận [17].
Cơ học: kết hợp đáp ứng sinh hóa và năng lượng áp dụng
Ở phổi bị tổn thương, có một phổ nhiều mức độ thông khí mô phổi, tạo ra sự thông khí không đồng nhất. Tính không đồng nhất của phổi gần đây đã được đề xuất như một yếu tố thúc đẩy VILI ở bệnh nhân ARDS, với thực tế là tổn thương phổi có thể xảy ra mặc dù đã sử dụng Vt và áp lực khuyến nghị, các thông số được coi là an toàn trong thông khí của phổi khỏe mạnh. Khái niệm về tác nhân gây căng thẳng (stress raisers) có thể giải thích những phát hiện này. Thuật ngữ tác nhân gây căng thẳng đề cập đến các yếu tố khu vực bổ sung có khả năng làm gia tăng thiệt hại. Những tác nhân gây căng thẳng tạo ra sự khuếch đại của căng thẳng được áp dụng ở một số vùng cục bộ nhất định của phổi, như những vùng thông khí mà sự không đồng nhất cao [19-22]. Ảnh hưởng có hại của strain khu vực cao trong phổi đã được xác nhận gần đây trong một mô hình lợn bị MV gây tổn thương, trong đó các vùng phổi có strain khu vực tăng lên có mối tương quan không gian với các vùng mô bị viêm [23]. Nghiên cứu này nhấn mạnh sự liên quan của việc hiểu rõ hơn về sự tiến triển theo không gian-thời gian của strain khu vực, chứng minh rằng strain là yếu tố quyết định có liên quan và nổi bật của VILI [23-25]. Sự phân bố không đồng nhất của áp lực mở trong toàn bộ phổi dẫn đến sự giãn nở quá mức của các vùng phổi có thông khí tốt (“phổi em bé”) và cả ở các vùng bị xẹp (kém thông khí) do các chu kỳ huy động – mất huy động lặp đi lặp lại. Việc tạo ra các lực cơ học gây tổn thương là không thể tránh khỏi khi áp dụng MV xâm lấn, do tính chất không đồng nhất của ARDS và động lực bơm lên/xẹp xuống của phổi. Có một sự kết hợp giữa các kích thích cơ học được áp dụng và phản ứng sinh hóa của tế bào phổi, một quá trình sinh học được gọi là quá trình dẫn truyền cơ học (mechanotransduction) [26,27]. Dẫn truyền cơ học có thể là một con đường gây tổn thương phổi khi các kích thích cơ học quá mức, gây ra phản ứng viêm ở phổi. Sự khuếch đại của tổn thương phổi, tức là VILI, phụ thuộc vào mức năng lượng mà nhu mô phổi tiêu tán và sự biến dạng của nó. Phổi không phân biệt nguồn gốc của các lực này có thể được tạo ra bởi MV hoặc bởi các cơ hô hấp. Bằng cách này, các cơ chế cơ sinh gây ra P-SILI có thể xảy ra có hoặc không có MV.
P-SILI khi thở máy
Có bằng chứng chắc chắn rằng thông khí tự phát trong khi MV có vai trò trong tiến triển của tổn thương phổi [28]. Mặc dù thở tự phát đã tỏ ra có lợi trong điều trị bệnh nhân ARDS nhẹ, các tác dụng ngược lại xảy ra khi tổn thương phổi nặng. Thở tự phát làm tăng tổn thương trong tổn thương phổi nặng, tăng áp lực xuyên phổi, xẹp phổi, xẹp phổi theo chu kỳ và các dấu hiệu mô học của tổn thương [28-32]. Nghịch lý của việc thở tự phát và tổn thương phổi có thể được giải thích bởi hành vi cơ sinh học giống chất rắn (solid-like biomechanical behavior) của phổi bị tổn thương. Một số cơ chế được mô tả đối với tổn thương phổi do gắng sức tự phát là tăng stress/ strain phổi, tăng tưới máu phổi và không đồng bộ bệnh nhân – máy thở. Việc tạo ra các cơn co thắt cơ hoành mạnh mẽ tạo ra áp lực màng phổi âm cao sẽ bị tiêu biến dọc theo bề mặt màng phổi tạng trong một hình dạng đồng nhất (hành vi của chất lỏng) trong trường hợp phổi khỏe mạnh, nhưng sự tiêu tan này không đồng đều trong trường hợp phổi ARDS và stress tập trung ở giữa các giai đoạn của phổi xẹp và phổi thông khí (hành vi chất rắn). Sự gia tăng stress phổi cục bộ này có liên quan đến tình trạng viêm phổi cao hơn ở các vùng phổi phụ thuộc trong các mô hình thử nghiệm. Ngoài ra, sự tăng hồi lưu tĩnh mạch và dao động của lưu lượng máu phổi có thể tạo ra phù phổi, và cuối cùng là rối loạn đồng bộ bệnh nhân – máy thở vì kích hoạt ngược (reverse triggering) có liên quan đến sự gia tăng Vt có thể gây ra VILI [30, 33, 34].
P-SILI không có thông khí áp lực dương
Những năm gần đây đặc biệt chú trọng đến các biện pháp can thiệp để ngăn ngừa MV như HFNC và NIV, duy trì thông khí tự phát và tránh VILI [35-39]. Các nghiên cứu thực nghiệm và thông tin lâm sàng gián tiếp đã đưa ra quan điểm ngược lại với cách tiếp cận này, cho thấy rằng nỗ lực thông khí tự phát không được điều chỉnh trong thời gian dài cũng có thể gây ra sự tiến triển của tổn thương phổi [13,14]. Mặc dù những điều này xảy ra, nhưng khuyến nghị hiện tại muốn tránh hoặc cố tình trì hoãn thời điểm bắt đầu MV có thể là phản trực giác.
Hiện tại, kiến thức về P-SILI ở bệnh nhân rút nội khí quản còn hạn chế. P-SILI xảy ra ở phổi khỏe mạnh không có MV, trong một số điều kiện, như tăng thông khí phút (⩒E). West và cộng sự đã mô tả sự hư hại của hàng rào phế nang-mao mạch do stress khi huấn luyện ngựa đua vào năm 1993 [40]. Các phát hiện tương tự đã được mô tả ở các vận động viên sau khi luyện tập cường độ cao kéo dài (như vận động viên ba môn phối hợp, vận động viên chạy marathon và vận động viên bơi lội), trên thực tế có thể dẫn đến phù phổi, nếu không có suy tim. Sau khi tập thể dục cường độ cao, các mẫu nội soi phế quản đã tìm thấy nồng độ hồng cầu, protein, albumin và tế bào viêm (bạch cầu trung tính) cao hơn, giống như các phát hiện ở các động vật có vú khác [41-44]. Những thay đổi này có thể tương quan với những thay đổi được Mascheroni và cộng sự mô tả trong một nghiên cứu thực nghiệm trên cừu [45]. Các tác giả đã quan sát thấy sự suy giảm nặng chức năng phổi sau 3,5–13 giờ của quá trình tăng thông khí do thuốc gây ra ở động vật thở tự nhiên không mắc bệnh phổi. Những thay đổi này được ngăn chặn bằng cách MV và dùng thuốc an thần – giãn cơ. Nghiên cứu này xác nhận rằng thông khí tự phát mạnh mẽ có thể ảnh hưởng đến phổi và MV được kiểm soát có thể ngăn ngừa hoặc làm giảm bớt tổn thương của phổi trong bối cảnh này [45]. Sự thay đổi chức năng phổi trong thí nghiệm này tỷ lệ nghịch với thời gian tiếp xúc với tăng thông khí. Như các tác giả đã chỉ ra, họ không thể phân biệt được nếu chỉ có “stress cơ học” là nguyên nhân gây ra những quan sát này. Lưu ý là trong thời gian quan sát, động vật được đặt nội khí quản (đường thở nhân tạo qua thanh môn) và không có thông khí áp lực dương. Thiết kế thử nghiệm này có thể góp phần làm suy giảm chức năng phổi bằng cách thúc đẩy xẹp phổi. Ví dụ, Hedenstierna và cộng sự mô tả rằng xẹp phổi sau phẫu thuật có thể dễ dàng đạt tới 50% tổng số mô phổi sau vài phút ngay cả khi gây mê không bình thường [46]. Xẹp phổi có thể góp phần gây ra P-SILI theo hai cơ chế chính: giảm FRC và tiếp theo là sự gia tăng strain động trong quá trình thông khí và tạo ra mô phổi không đồng nhất [17, 19, 47, 48].
Gần đây, chúng tôi đã phát triển một nghiên cứu chụp cắt lớp 4D sử dụng phân tích cơ sinh học dựa trên hình ảnh [49] để tiết lộ sự phân bố thể tích của strain khu vực của toàn bộ phổi ở những đối tượng không có MV. Ở những con chuột được an thần khỏe mạnh trong điều kiện thở tự nhiên (không được trợ giúp), chúng tôi quan sát sự biến dạng khu vực theo thể tích và sự không đồng nhất về strain, định lượng độ lớn của các chỉ số biến dạng này và sự tiến triển của nó theo thời gian [50]. Với thực tế là strain khu vực và không đồng nhất hiện diện trong một chu kỳ hô hấp bình thường mà không gây hại cho phổi dẫn đến câu hỏi: tại sao P-SILI không phát triển trong phổi bình thường bị biến dạng bởi Vt sinh lý? Câu trả lời có lẽ liên quan đến nhiều yếu tố, như lượng áp lực xuyên phổi được tạo ra, sự bù trừ của hàng rào phế nang-mao mạch và độ lớn và sự phân bố địa hình của năng lượng tiêu tán trên phổi. Một lời giải thích khả thi có thể là tính nhạy cảm với P-SILI phụ thuộc vào kích thước của FRC, trước khi bị tổn thương do strain toàn cục cao. Mất thể tích phổi được sục khí bình thường có hai tác động chính: ít mô phổi có khả năng biến dạng trong chu kỳ thở và tăng lực co cơ hoành. Đối với cùng một Vt, phổi có FRC thấp hơn vốn dĩ dễ bị ảnh hưởng bởi strain khu vực toàn cục. Thể tích phổi giảm có ảnh hưởng quan trọng đến vị trí và chức năng của cơ hoành. Sự dịch chuyển lên phía trên dẫn đến độ cong lớn hơn của cơ hoành và sự gia tăng kích thước của vùng co thắt. Hơn nữa, các sợi cơ hoành được kéo dài ra, làm tăng khả năng tạo ra lực của nó trong quá trình co.
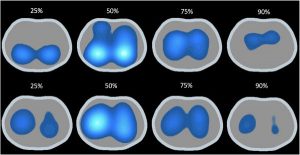
”Hình ảnh tương ứng với một chu kỳ hô hấp hoàn chỉnh và nó được phân chia từ khi bắt đầu hít vào cho đến khi kết thúc quá trình. Quan sát sự khác biệt trong mô hình bớm phồng phổi. Khi bắt đầu thông khí thì hít vào bắt đầu ở các vùng phổi phụ thuộc nhiều nhất ở nhịp thở tự phát (SB) và các vùng trung tâm hơn ở thở máy VCV. Vào cuối thời gian hít vào thì chủ yếu là vùng phổi lưng ở SB và chủ yếu là vùng trung tâm ở VCV. Thời điểm bắt đầu thở ra cho thấy sự dịch chuyển của trung tâm thông khí hướng đến vùng phổi bụng ở SB và duy trì vùng trung tâm ở VCV. Vào cuối thời gian thở ra, người ta quan sát thấy rằng sự thông khí đã kết thúc ở phần bụng của phổi trong trường hợp SB và ở vùng phổi trung gian của VCV. Được sửa đổi từ: Bachmann MC, Basoalto R, Soto, et al. Chăm sóc chuyên sâu Med Exp. 2018; 6 (Phần 2): 0274”
Nếu chức năng thần kinh cơ hô hấp còn nguyên vẹn, thì tăng hoạt hóa trung khu hô hấp chuyển thành co cơ hoành mạnh hơn và áp lực âm “dao động” lớn hơn. Điều này đã được chứng minh trong các nghiên cứu trong phòng thí nghiệm, trong đó nỗ lực tự phát lớn hơn trong trường hợp tổn thương phổi nặng hơn. Nỗ lực tự phát mạnh mẽ hơn có liên quan tuyến tính với mức độ Pendelluft lớn hơn, cũng như thể tích khí lưu thông và strain khu vực lớn hơn (Hình 1).
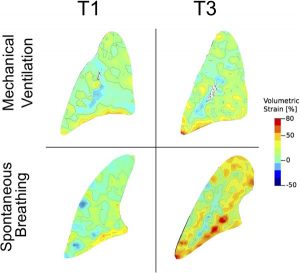
”Nhóm I: đối tượng bị tổn thương phổi do thở máy thể tích khí lưu thông thấp khi bắt đầu thí nghiệm (T1) và khi kết thúc thử nghiệm (T3) (hình trên bên trái và bên phải). Nhóm II: đối tượng bị tổn thương phổi thở tự phát (không thở máy) ở đầu thí nghiệm (T1) và cuối thí nghiệm (T3) (hình dưới bên trái và bên phải). Sự tiến triển của strain khu vực và không đồng nhất về thời gian được quan sát thấy trong nhịp thở tự phát, đạt mức căng thể tích lên đến 80%. Sự phân bố strain khu vực vẫn đồng đều và đồng nhất hơn trong thở máy thể tích khí lưu thông thấp”
Trong một nghiên cứu thực nghiệm tiếp theo, chúng tôi so sánh động vật bị tổn thương phổi cấp tính trong điều kiện MV có kiểm soát và thở tự nhiên mà không cần MV. Tổn thương phổi được gây ra bởi rửa phổi ở chuột, sau đó là 3 giờ thở tự phát hoặc Vt-MV thấp. Hình ảnh micro-CT được thu thập vào đầu và cuối giai đoạn quan sát, và bản đồ biến dạng khu vực 4D đã được xây dựng.
Chúng tôi nhận thấy sự tiến triển rõ rệt trên phim chụp cắt lớp của vùng mô không được sục khí, và sự giảm của vùng mô phổi bình thường, phù hợp với hiện tượng mất huy động. Ngoài ra, chúng tôi nhận thấy sự tiến triển đáng kể của strain thể tích khu vực và sự không đồng nhất sau khi thở tự phát. Ngược lại, Vt-MV thấp đã hạn chế sự tiến triển của strain khu vực và tính không đồng nhất vào cuối nghiên cứu (Hình 2) [51]. Sự không đồng nhất của phổi có liên quan đến mức độ nặng và tử vong của ARDS [19]. Mead và cộng sự được mô tả trong một mô hình lý thuyết về sự phụ thuộc lẫn nhau của phế nang, có thể tập trung lực căng lên gấp 4 lần so với sức căng toàn cục áp dụng cho hệ thống [52]. Vài năm trước, nhóm của chúng tôi đã chỉ ra rằng vùng quanh xẹp phổi trong mô hình chuột bị tổn thương MV có nhiều vùng viêm và gián đoạn phế nang hơn phần còn lại của phổi [53]. Nếu chúng ta dự đoán sự phụ thuộc lẫn nhau của các phế nang vào phổi không đồng nhất với nhiều vùng xẹp, chúng ta có thể giải thích điều này là nguyên nhân gây viêm trong quá trình thông khí tự phát.
Nhóm của chúng tôi hiện đang nghiên cứu mối tương quan về địa hình của các khu vực strain và viêm nhiễm trong mô hình P-SILI. Chúng tôi đã đo các con đường biểu hiện gen trên đồng nhất mô phổi và mô học phổi. Kết quả sơ bộ ủng hộ giả thuyết của chúng tôi. Vùng quan tâm (ROI, regions-of-interest) có strain khu vực cao đã tăng biểu hiện của các gen liên quan đến quá trình apoptosis, tín hiệu IL-2, tín hiệu protein G, kích hoạt các kênh ion kích hoạt phối tử, đông máu và viêm, trong số những gen khác, so với ROI với strain khu vực thấp (Hình 3). Một biểu hiện gen tương tự đã được xác định ở những vùng có độ căng (stretch) cao ở chuột được thở máy trong mô hình strain phổi toàn cục cao [24].
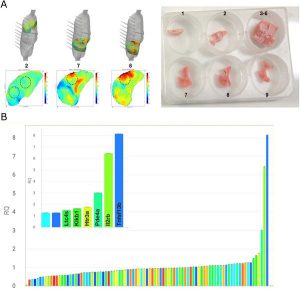
”a Hình ảnh đại diện của in vivo/ex vivo phù hợp giữa bản đồ chụp cắt lớp vi mô vùng và phổi đông lạnh được số hóa 3D. Các vùng màu đỏ đại diện cho các vùng strain cao, trong khi các vùng xanh lục/xanh lam đại diện cho các vùng strain thấp trong nhịp thở tự phát. Các vùng strain thấp và cao từ cùng một phổi đông lạnh đã được cắt, đồng nhất và tinh sạch RNA. b Sự biến đổi biểu hiện gen của quá trình truyền tải cơ học/bệnh lý giữa các vùng của khu vực strain cao và strain thấp. Các gen làm tăng sự biểu hiện của chúng ở những vùng có strain cao là TNF Superfamily Member 13b (Tnfsf13b,> 8 lần), Tiểu đơn vị thụ thể Interleukin-2 beta (Il2rb,> 6 lần), Phosphodiesterase 4A (Pde4A, ~ 3 lần), 5- thụ thể hydroxytryptamine 3A (Htr3a), kallikrein huyết tương (Klkb1) và Leukotriene C4 Synthase (Ltc4s). Các gen này liên quan đến quá trình apoptosis, tín hiệu IL-2, tín hiệu protein G, kích hoạt các kênh ion hoạt hóa phối tử, đông máu và viêm tương ứng.”

”Nhóm I: đối tượng bình thường (phổi không bị tổn thương) thở tự phát (không thở máy) (a, b). Nhóm II: đối tượng bị tổn thương phổi được thở máy Vt thấp (c, d). Nhóm III: đối tượng bị tổn thương phổi được thở tự phát (không thở máy) (f – j). Trong tập hình ảnh đầu tiên, không có phù nề hoặc thâm nhiễm quanh mạch được đánh giá ở × 100 (a) và × 200 (b). Trong tập hình ảnh thứ hai, đôi khi quan sát thấy lượng dịch quanh mạch máu tối thiểu ở × 100 (c – e). Trong bộ hình ảnh thứ ba, chúng tôi quan sát thấy sự phá vỡ thành phế nang và xuất huyết ở × 400 (f), phù quanh mạch và xuất huyết ở × 200 (g), xung huyết dữ dội ở giường mạch nhu mô phổi với các dấu hiệu phù quanh mạch ban đầu và thâm nhiễm bạch cầu ở × 200 (h), xung huyết dữ dội và tích tụ bạch cầu quanh mạch ở × 100 (i), và tích tụ quanh mạch của bạch cầu đa nhân trung tính và tế bào lympho ở × 400 (j)”.
Lưu ý rằng trong mô hình P-SILI của chúng tôi, động vật thở tự phát có mức độ tổn thương mô bệnh học cao hơn so với Vt-MV thấp, cụ thể là phá vỡ thành phế nang và xuất huyết, tăng urê huyết, và thâm nhiễm bạch cầu (Hình 4). Điều thú vị là mặc dù các hiện tượng cơ sinh học và biểu hiện gen là khu vực, nhưng tổn thương phổi lại lan tỏa.
Có thể giải thích cho điều này là nhiều dấu ấn sinh học được đề cập là tan trong nước và dễ dàng khuếch tán trong huyết tương và dịch tiết đường hô hấp, vì vậy chúng có thể được tiết ra cục bộ, nhưng hậu quả của chúng là lan tỏa hơn và thậm chí ở khoảng cách xa.
Cơ sở lý luận của hỗ trợ không xâm lấn trong ARF do SARS-CoV2: nỗi sợ hãi giả định so với thực tiễn phổ biến
Gattinoni và cộng sự gần đây đã mô tả hai kiểu hình ở bệnh nhân SARS-CoV2, “không phải ARDS” loại 1 (hoặc loại L), và ARDS, loại 2 (hoặc loại H) [12, 54]. Loại 1 đề cập đến bệnh viêm phổi COVID-19 ban đầu, đặc trưng bởi độ đàn hồi thấp, tỷ lệ V/Q thấp, trọng lượng phổi thấp và khả năng huy động thấp. Ngược lại, loại 2 đáp ứng các tiêu chí cổ điển của ARDS. Trong một loạt trường hợp nhỏ gồm 16 bệnh nhân, các tác giả mô tả rằng bệnh nhân chuyển từ loại 1 sang loại 2 sau 1 tuần hỗ trợ không xâm lấn. Các tác giả đề xuất rằng đối mặt với tăng hoạt hóa trung khu hô hấp, P-SILI chịu trách nhiệm của việc tiến triển từ kiểu hình COVID-19 loại 1 sang loại 2.
Dữ liệu thực nghiệm ban đầu của chúng tôi cho thấy rằng một cơ chế của quá trình quan sát lâm sàng của Gattinoni và cộng sự có thể do biến dạng thể tích vùng phổi và sự dẫn truyền cơ học bệnh lý gây ra bởi nhịp thở tự phát do strain cao. Vì phổi không phân biệt nguồn gốc của lực tạo ra biến dạng thể tích, cho dù lực đó có thể được tạo ra bởi thở máy (VILI) hay cơ hô hấp. Theo quan điểm này, cơ chế cuối cùng này có thể được mô tả chính xác hơn là “tổn thương phổi do gắng sức”, thay vì P-SILI.
Như một số tác giả đã chỉ ra, kiểu hình loại 1 và loại 2 là sự đơn giản hóa quá mức của ARF do SARS-CoV2, vì không thể quy cho một cơ chế duy nhất sự phức tạp của COVID-19. Do đó, hỗ trợ hô hấp, không xâm lấn và xâm lấn, không thể được quyết định trên một thông số duy nhất để ngăn ngừa các biến chứng tiềm ẩn và giảm tỷ lệ mắc bệnh và tử vong.
Sinh lý bệnh của suy hô hấp COVID-19 [55] giải thích tại sao bệnh nhân bị COVID-19 thường có biểu hiện giảm oxy máu từ trung bình đến nặng, vì vậy có vẻ thích hợp sử dụng liệu pháp oxy tiêu chuẩn, HFNC và NIV như hỗ trợ hô hấp ban đầu. Do sự trái ngược giữa giảm oxy máu và suy hô hấp, điều quan trọng cần lưu ý là các nghiên cứu trước đây cho thấy phân tầng theo mức độ trầm trọng của giảm oxy máu kèm Vt cao (lớn hơn 9,5 mL/kg [56] hoặc 9 mL/kg [57]) dự đoán thất bại hỗ trợ của NIV. NIV thất bại có liên quan đến tử vong [5], trong đó strain toàn cục cao có thể có vai trò trong sự tiến triển của tổn thương phổi. Điều thú vị là một nghiên cứu đã chỉ ra rằng việc sử dụng mũ bảo hiểm (helmet) làm giao diện cho NIV có liên quan đến kết quả tốt hơn so với giao diện truyền thống. Liệu khả năng cung cấp PEEP cao hơn có thể là một phần của lời giải thích hay không [7]. PEEP cao có thể làm giảm chuyển động hô hấp, thay đổi áp lực âm và strain toàn cục/khu vực do di lệch và rút ngắn cơ hoành. Theo cách này, Sartini và cộng sự gần đây đã mô tả tác động của NIV và chu kỳ nằm sấp ở bệnh nhân suy hô hấp COVID-19 [58]. Họ phát hiện ra sự giảm đáng kể về tần số thở và sự cải thiện của các thông số oxy hóa.
Không thể đánh giá chức năng hô hấp riêng rẻ ở bệnh nhân suy hô hấp COVID-19 cũng như các bệnh nhân ARDS do nguyên nhân khác. Một ví dụ rõ ràng trong nghiên cứu của Carteaux và cộng sự nơi sự ức chế miễn dịch và mức độ nặng cũng như liên quan đến thất bại NIV [56]. Như đã giải thích ở trên, giảm oxy máu không thường xuyên là nguyên nhân chính gây ra suy hô hấp, vì vậy điều quan trọng là phải xem xét các yếu tố khác cũng như các chức năng của cơ quan không hô hấp, như chấn thương thận cấp tính, cơ tim và rối loạn chức năng nội mô nặng; tất cả đều chung trong SARS-CoV2 [59-62]. Việc đánh giá đúng các yếu tố này mang lại cơ hội duy nhất cho các phương pháp điều trị COVID-19 không qua đường hô hấp.
HFNC đã cho thấy những kết quả đáng chú ý là hỗ trợ hô hấp ban đầu trong ARF mới mắc [63], cải thiện oxygen hóa và giảm tỷ lệ chăm sóc và đặt nội khí quản khi so sánh với liệu pháp oxy tiêu chuẩn [63-65]. Lợi ích có thể là do giảm khoảng chết giải phẫu, giảm nhu cầu thông khí và công thở (WOB, work of breathing) [66]. Ở COVID-19, HFNC được chứng minh là an toàn, dung nạp tốt và nó có tác dụng hiệp đồng khi kết hợp với các phương pháp điều trị khác như nằm sấp [67-71].
Tư thế nằm sấp đã được nghiên cứu rộng rãi ở bệnh nhân ARDS và MV xâm lấn, cho thấy sự cải thiện oxygen hóa do nhiều cơ chế, như cải thiện FRC, không đồng nhất thông khí/tưới máu, chuyển động cơ hoành ở vùng lưng, tăng thông khí vùng ở các vùng phổi phụ thuộc, trong số những cơ chế khác [72, 73]. Một số nguyên tắc của tư thế nằm sấp có thể được áp dụng cho bệnh nhân rút nội khí quản tỉnh táo, nhưng sinh lý học vẫn chưa được biết sâu. Nó đã được chứng minh là một biện pháp can thiệp an toàn, và hiện nay, nó được sử dụng rộng rãi trong phòng cấp cứu, các khoa ngoại tổng quát cũng như các cơ sở ICU [58, 68-71].
Các khái niệm sinh lý học về HFNC, NIV và tư thế nằm sấp cũng có thể được áp dụng cho bệnh nhân ARF giảm oxy máu thứ phát sau nhiễm SARS-CoV2. Các bệnh đi kèm có liên quan nhiều đến việc lựa chọn chiến lược hỗ trợ không xâm lấn đã chọn (tức là bệnh lý béo phì, COPD, suy tim mãn tính). Tư thế nằm sấp có thể làm giảm P- SILI bằng cách giảm áp lực căng thẳng và sự thay đổi âm tính của áp lực trong lồng ngực, và quan trọng hơn là tăng FRC. Về mặt lý thuyết, những cơ chế này có thể cải thiện hiện tượng phụ thuộc lẫn nhau của phế nang bằng cách giảm strain toàn cục và tính không đồng nhất.
Một cách tiếp cận thực dụng đối với ARF do SARS-CoV2
Một số tác giả đã nhấn mạnh tầm quan trọng của phương pháp tiếp cận sinh lý đối với SARS-CoV2 ARF [74-78]. Chúng tôi đặc biệt khuyến nghị một cách tiếp cận thận trọng đối với suy hô hấp do SARS-CoV2. Giảm oxy máu đơn thuần (cũng như tất cả các thông số có nguồn gốc, như tỷ lệ P/F) không nên đặt nội khí quản, và PaO2 thấp từ 50 đến 60 mmHg có thể được dung nạp khi không có bằng chứng về tưới máu cơ quan nội tạng thấp hoặc có dấu hiệu khó thở. Tất cả các dấu hiệu rõ ràng của MV xâm lấn, như huyết động không ổn định, thay đổi ý thức, nên được đánh giá cẩn thận theo thời gian. Theo kinh nghiệm của chúng tôi, ở hầu hết những bệnh nhân này, việc đặt ống nội khí quản có thể được ngăn ngừa bằng cách sử dụng phương pháp hỗ trợ không xâm lấn kịp thời và điều trị sớm các biến chứng đã xác định hoặc nghi ngờ. Một lưu ý đặc biệt là ngăn ngừa tình trạng quá tải dịch ở những bệnh nhân này, mặc dù phần lớn thời gian biểu hiện ban đầu là mất nước ở một mức độ nào đó khi không có chấn thương thận cấp tính. Lưu ý là chụp CT không thay đổi cách xử trí thông thường của chúng tôi. Khi bệnh nhân phát triển tăng WOB (nhịp thở lớn hơn 35 nhịp thở mỗi phút, tăng hoạt động của các cơ hô hấp, khó thở và thở ngắn), cần đánh giá và điều trị kịp thời các nguyên nhân thứ phát [78-81], bao gồm suy cơ quan cuối, nghi ngờ sớm về bội nhiễm vi khuẩn, và các biến cố huyết khối tắc mạch. Điều này phù hợp với khái niệm đánh giá khó thở đa chiều do Banzett và cộng sự đưa ra [79, 81].
Chúng tôi thừa nhận rằng không có ngưỡng rõ ràng để quyết định MV xâm lấn, ngay cả khi xem xét giảm oxy máu và tăng WOB. Một hạn chế đặc biệt là không có tiêu chuẩn đo lường mức độ suy hô hấp trong suy hô hấp COVID-19. Với những thực tế này, có nhiều khía cạnh của P-SILI vẫn đang được tranh luận và hiểu biết hiện tại của chúng ta còn rất hạn chế về vai trò của P-SILI trong tiến triển của bệnh phổi [78]. Điểm mấu chốt có thể là khả năng chịu đựng của bệnh nhân đối với các biện pháp không xâm lấn và đáp ứng với điều trị, mặc dù đó cũng là một quyết định chủ quan. MV là một biện pháp can thiệp cứu sống trong nhiều trường hợp, nhưng lại tiềm ẩn nhiều nguy cơ tai biến. P-SILI trong khi MV có thể xảy ra trong những tình huống không thể kiểm soát được khi tăng hoạt hóa trung khu hô hấp. Khuyến cáo dùng một đợt thuốc an thần sâu và thuốc chẹn thần kinh cơ (NMB) ngắn hạn, đánh giá thời gian ngừng thuốc hàng ngày (NMB- holiday) [82, 83]. Việc cai máy thở của ARF- COVID-19 cũng cần đặc biệt lưu ý. Chúng tôi đã quan sát thấy nhiều tình huống trong đó WOB tăng do nhu cầu ⩒E cao, không liên quan đến diễn biến của bệnh viêm phổi COVID-19, có thể dẫn đến thất bại cai máy, kéo dài thời gian MV hoặc cuối cùng là thất bại khi rút nội khí quản. Các tình huống thông thường bao gồm sốt nặng do tình trạng viêm nhiễm toàn thân chưa được giải quyết, mê sảng, bội nhiễm, hội chứng cai thuốc và nhiễm toan. Các bác sĩ lâm sàng cần ngăn ngừa chúng trước khi cai máy và rút nội khí quản (tức là bắt đầu sử dụng thuốc chống rối loạn tâm thần sớm, ngừng truyền benzodiazepin sớm, kiểm soát nhiệt độ, v.v.). Tất cả các khía cạnh này được sử dụng để đánh giá ARF do SARS-CoV2 của chúng tôi. Nó bao gồm đánh giá đa hệ thống (không chỉ hệ hô hấp) để quyết định hỗ trợ hô hấp thích hợp, xâm lấn hay không xâm lấn, và điều chỉnh các yếu tố khác làm tăng nhu cầu ⩒E và WOB [79]. Sau khi đặt nội khí quản, chăm sóc thông thường để ngăn ngừa biến chứng được tiến hành [75, 77], và các điều kiện để cai máy thành công và rút nội khí quản được đánh giá hàng ngày, để ngăn ngừa thời gian kéo dài quá mức của MV và bệnh tật và tử vong liên quan [77, 82, 84].
Phần kết luận
Theo hiểu biết của chúng tôi, P-SILI có thể là một trong nhiều yếu tố có thể giải thích sự tiến triển của bệnh phổi ở COVID-19. Chúng tôi đã đưa ra dữ liệu thí nghiệm sơ bộ rằng có thể xác định được strain và không đồng nhất của phổi trong khu vực ở những phổi bị tổn thương nặng khi thở tự phát không được trợ giúp. Chúng có khả năng gây ra sự tiến triển của xẹp phổi, viêm và những thay đổi tiến triển của cơ học phổi. Sử dụng sớm MV với Vt thấp có kiểm soát có thể ngăn chặn sự tiến triển này. Với tình trạng đại dịch hiện tại do SARS-CoV2 và sự thiếu hụt nguồn lực y tế, như máy thở cơ học, các bác sĩ phải cân đối các can thiệp hỗ trợ hô hấp dựa trên sinh lý bệnh của ARF, nhưng họ cũng phải tính đến sự tiến triển của mức độ nặng của bệnh có thể hậu quả của việc hỗ trợ hô hấp không đầy đủ ở những đối tượng phải làm việc với nhịp thở cao, ngay cả khi nó không phải là nguyên nhân dẫn đến suy hô hấp.